【Ann Oncol】血浆蛋白组学助力预测免疫检验点阻断剂抵抗的全新生物标志物

伴随诊断CDx(Companion Diagnostics)是一种体外诊断技术,通过生物标志物(Biomarker)的客观检测和实时评价,以帮助确定哪些患者最可获益于特定的治疗产品,哪些患者可能因治疗而发生严重的副作用,进而监控治疗过程,以便调整治疗方案,使药物治疗的安全性和有效性得以改善。使用多种生物标志物来确定疾病状态,通常被称为“生物标志物组合”,是一种充分利用蛋白标志物的更准确、更有效方法。
制药公司在开发新药,尤其是抗肿瘤药物时,常常会发现药物对某些特定的患者人群是有效的,而对其他人群则无效。这时候正确的选择生物标志物,将会大大提高药物的临床试验及上市的成功率。
法国Institut Bergonie的Antoine研究组在国际杂志Annals of Oncology(IF = 32.98)上发表了最新研究成果:首次报导了基于最新的Olink蛋白组技术,对接受ICB治疗前的癌症患者队列样本进行了大规模血浆蛋白质组分析,并从中筛选到白血病抑制因子LIF为一种全新的ICB疗效预测外周血蛋白标志物。与传统生物标志物(如PD-L1表达,肿瘤突变负荷TMB、微卫星不稳定性MSI)相比,该循环蛋白生物标志物的发现为解决与肿瘤组织分析相关的局限(如时间和空间肿瘤异质性)提供了一种更有前景的方法。
在肿瘤生物标志物发现的过程中,研究者往往会从肿瘤组织图谱入手,但这往往会受到取材方面的限制,比如说样本的可获得性、时间和空间的限制等等。如果能从肿瘤患者的血浆入手去发现新的生物标志物,那么免疫治疗的临床实践就会变得便捷的多。
为了从血浆中寻找预测免疫治疗效果的标志物,Italiano团队获取了两个接受ICB治疗的癌症晚期患者前瞻性队列(MATCH-R和PREMIS)研究数据。他们把MATCH-R(95名患者)作为建模队列,PREMIS(292名患者)作为验证队列。
Italiano和他的同事收集了建模队列患者的血液和肿瘤组织样本,并对血浆样本进行蛋白质组学分析(使用了Olink Explore 1536 panel),对肿瘤活检样本进行免疫组化(评估肿瘤PD-L1表达、CD8 T细胞密度和三级淋巴结构的存在)和RNA-seq分析(肿瘤免疫基因表达谱)。然后计算上述数据和临床数据(持久临床获益和非持久获益)之间的相关性,选择适合的生物标志物。
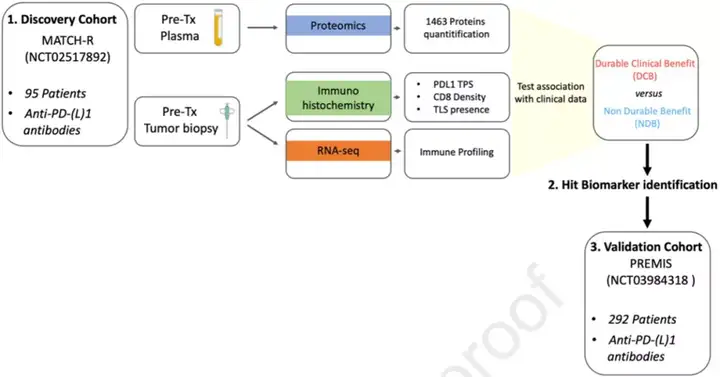
图1 流程图
研究发现,LIF与患者的临床结局相关性最显著。基于此,Italiano团队围绕LIF开展详细的研究。
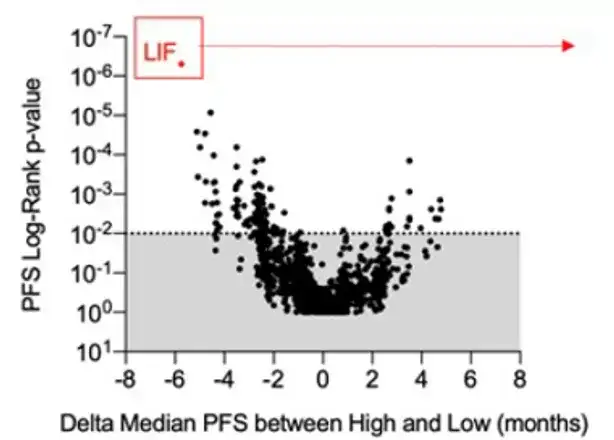
图2 血浆LIF与患者的临床结局相关性
研究表明,在随访时间为26.4个月的时间里,血浆LIF水平高的癌症患者的中位无进展生存期(PFS)为1.7个月,而血浆LIF水平低的癌症患者的中位PFS长达7.4个月。
与血浆LIF水平高的癌症患者的6个月PFS率(17%)、1年PFS率(6.4%)和2年PFS率(0%)相比,血浆LIF水平低的癌症患者的6个月PFS率(55.9%)、1年PFS率(41.5%)和2年PFS率(16.2%)均明显升高。
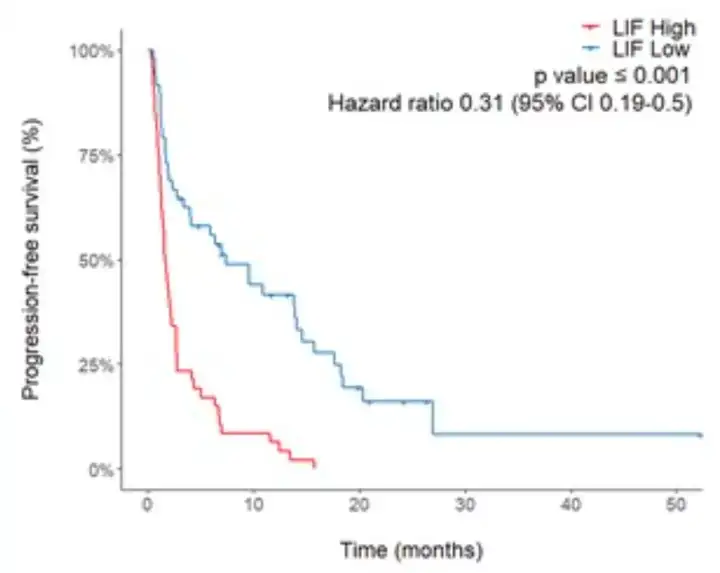
图3 血浆LIF与癌症患者的无进展生存期
同样的,血浆LIF水平高的癌症患者的中位生存期(OS)为4.3个月,而血浆LIF水平低的癌症患者的中位生存期长达21.7个月,后者竟是前者的5倍。
与血浆LIF水平高的癌症患者的6个月OS率(40.4%)、1年OS率(29%)和2年OS率(10.6%)相比,血浆LIF水平低的癌症患者的6个月OS率(81.1%)、1年OS率(67.8%)和2年OS率(47.2%)也均明显升高。
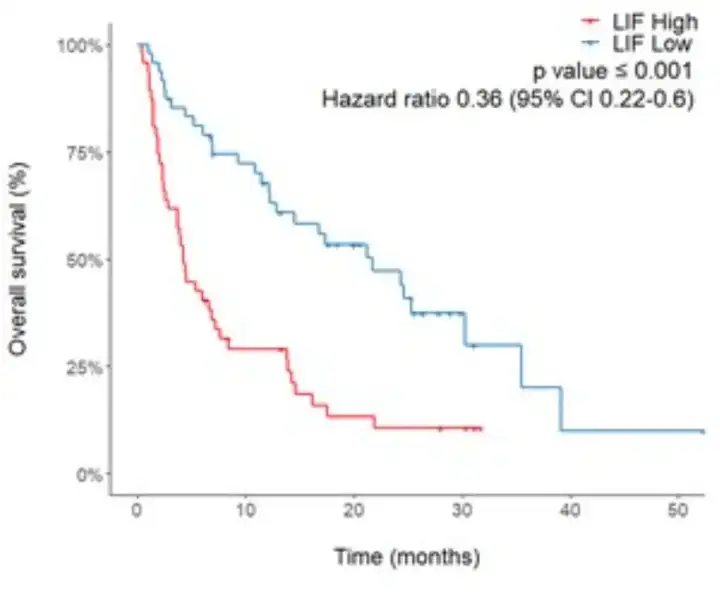
图4 血浆LIF与癌症患者的总生存期
随后,Italiano和他的同事还研究了血浆LIF水平与患者持久临床获益(DCB)和非持久获益(NDB)之间的关系。(DCB是指癌症病人接受治疗后病情缓解,病情稳定且PFS>12个月;NDB是指癌症病人接受治疗后病情缓解,病情稳定且PFS ≤12个月)。
他们发现,与血浆LIF水平高的癌症患者相比,血浆LIF水平低的癌症患者有更好的临床受益表现,具体来看,血浆LIF水平高的癌症患者的持久临床获益率仅有6.4%,而血浆LIF水平低的癌症患者的持久临床获益率高达41.7%。
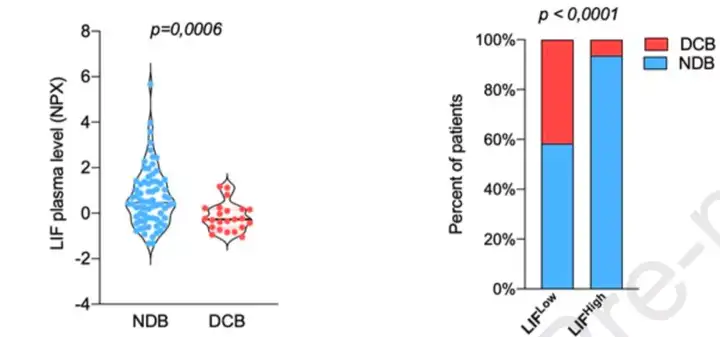
图5 血浆LIF与抗PD-1抗体治疗的癌症患者的临床获益
接下来,Italiano和他的同事根据PD-L1表达评分和CD8 T细胞浸润密度来探究LIF水平与临床结局的关系。
Italiano和他的同事发现,PD-L1阳性和阴性肿瘤患者的外周血LIF水平没有明显差距。PD-L1阳性肿瘤在高水平LIF(46.1%)肿瘤和低水平LIF(55%)所占比例基本上相似。
在PD-L1 TPS<1%的癌症患者中,血浆LIF高表达的癌症患者的中位PFS仅有1.5个月,而血浆LIF低表达的癌症患者的中位PFS长达7个月;同样的,在PD-L1 TPS≥1%的癌症患者中,血浆LIF高表达的癌症患者的中位PFS只有2.2个月,而血浆LIF低表达的癌症患者的中位PFS为6.3个月,也是明显延长。
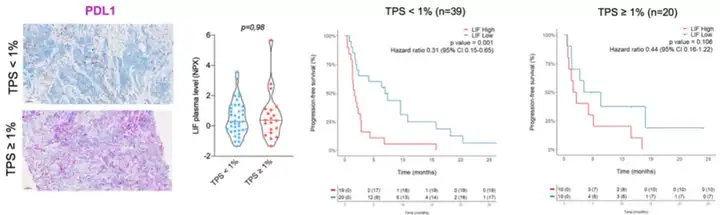
图6 根据PD-L1表达评分探究LIF水平与临床结局的关系
总的来说,无论癌症患者PD-L1表达状态如何,LIF水平低的肿瘤患者有更好的预后。
接着,Italiano团队根据CD8 T细胞密度以同样的方式研究了LIF和临床结局的关系。
他们对CD8 T细胞高度浸润的定义是:CD8 T细胞密度超过262.7/mm²。与PD-L1不同的是,当CD8 T细胞高度浸润肿瘤时,血浆LIF的表达水平较低。
此外,在CD8 T细胞浸润低的癌症患者中,与血浆LIF高表达的癌症患者的中位PFS相比,血浆LIF低表达的癌症患者的中位PFS明显延长;但是在CD8 T细胞浸润高的癌症患者中,没有观察到统计学意义,研究者认为可能是样本量较低导致的。
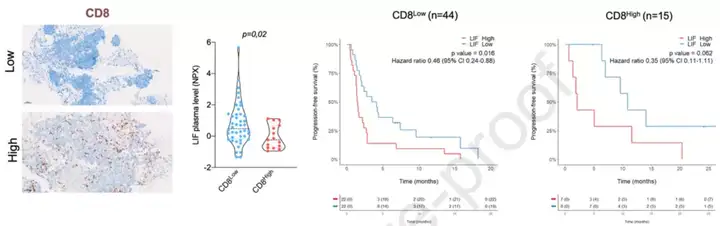
图7 根据CD8 T细胞密度探究LIF水平与临床结局的关系
至于血浆中的LIF水平是否与肿瘤内免疫景观相关。
Italiano团队发现,LIF水平与B细胞和滤泡辅助性T细胞呈明显的负相关,B细胞和滤泡辅助性T细胞是TLS的主要组成部分。研究者采用多重免疫组化来评估肿瘤样本中的TLS[7]。
与血浆LIF高表达的癌症患者的TLS阳性病例的比例(24.1%)相比,血浆LIF低表达的癌症患者的TLS阳性病例的比例(50%)明显增加。
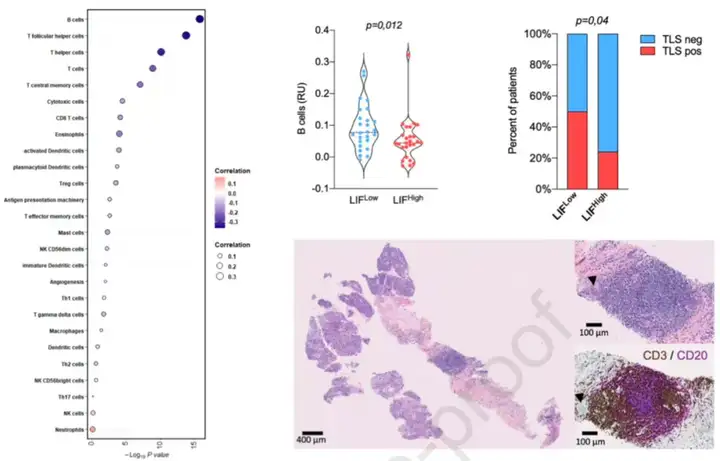
图8 LIF与三级淋巴结构的存在相关
以上基于建模队列的研究确认了LIF适合做生物标志物,紧接着,Italiano团队又用验证队列去验证上述发现。
他们基于验证队列的数据发现,与血浆LIF高表达的癌症患者相比,血浆LIF低表达的癌症患者的PFS(5.1个月 vs 2.6个月)、生存期(未达到 vs 8.5个月)、客观缓解率(32.2% vs 16.4%)、临床获益率(34.2% vs 17.8%)都显著提升。
不难看出,这结果表明了LIF是可以作为PD-1抑制剂治疗的生物标志物。
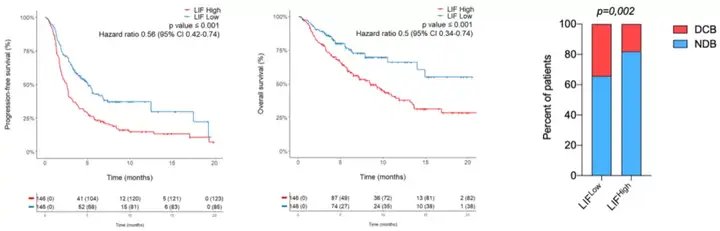
图9 LIF可预测PD-1治疗的预后
最后,Italiano团队还通过多因素分析发现血浆LIF水平与PFS和OS都独立相关。
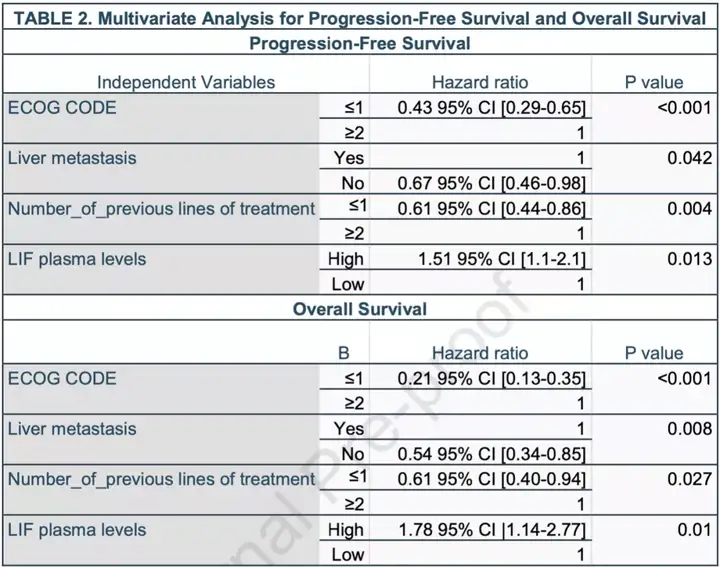
图10 血浆LIF与PFS和OS独立相关
总而言之,Italiano团队发现LIF确实可以作为PD-1抑制剂治疗的预后标志物。
LIF作为PD-1抑制剂治疗的预后标志物,这不仅可以了解抗PD-1抗体的敏感性和耐药机制,同时也可以更好地开发癌症免疫治疗的药物。在血浆中检测LIF在常规临床实践也更容易实现;LIF作为一种血液生物标志物,可以解决与肿瘤组织分析相关的缺陷,如肿瘤的时空异质性。
原文出处:Plasma proteomics identifies Leukemia Inhibitory Factor (LIF) as a novel predictive biomarker of immune-checkpoint blockade resistance. Ann Oncol. 2021 Aug 17;S0923-7534(21)03978-8. doi: 10.1016/j.annonc.2021.08.1748.

